Нітратна кислота
Фізичні властивості
Чиста нітратна (азотна) кислота - HNO3 – безбарвна рідина з різким подразнюючим запахом, дуже гігроскопічна, летка, важча за воду. Безводна нітратна кислота «димить» на повітрі внаслідок утворення туману, який складається з крапельок розчину кислоти. Кислота змішується з водою в будь-яких співвідношеннях. Водний розчин нітратної кислоти з масовою часткою кислоти 96 – 98 % називається концентрованою кислотою. Концентрована нітратна кислота забарвлена в жовтий колір. Такого кольору надає їй нітроген(IV) оксид NO2, який утворюється внаслідок часткового розкладу нітратної кислоти і розчиняється в ній. На практиці використовують водний розчин кислоти з масовою часткою 63-65% НNO3, таку кислоту також називають концентрованою. Густина 1,53 г/см³. Кипить при 86°С, замерзає при 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
| Нітратна кислота | |
|---|---|
Структурна формула азотної кислоти | |
Резонансна структурна формула | |
Резонансна структурна формула | Тривимірна модель молекули |
Добування
Хімічні процеси, що відбуваються при виробництві нітратної кислоти, можна представити рядом реакцій: 1. Суміш аміаку з повітрям у певному співвідношенні спалюють у спеціальному приладі на платиновій сітці, яка служить каталізатором (без каталізатора аміак окиснюється до вільного азоту):
4NH3 + 5O2 = 4NO + 6H2O
2.Одержуваний монооксид азоту охолоджують і окиснюють киснем повітря до діоксиду (гемітетраоксиду) азоту:
2NO + O2 = 2NO2
3. Суміш діоксиду і гемітетраоксиду поглинають водою і одержують розчин суміші нітратної і нітритної кислот:
N2O4 + H2O = HNO3 + HNO2
4.Нітритна кислота нестійка, особливо при деякому нагріванні, і легко розкладається на монооксид і діоксид азоту і воду:
2HNO2 = NO + NO2 + H2O
Процес поглинання оксидів азоту водою проводять при надлишку кисню. Тому утворюваний за останньою реакцією монооксид азоту відразу перетворюється в діоксид азоту і знову вступає в процес утворення нітратної кислоти. В результаті утворюється лише нітратна кислота.
Хімічні властивості.
Нітратна кислота належить до сильних одноосновних кислот. У водному розчині вона майже повністю дисоціює. Кислота проявляє загальні властивості кислот: взаємодіє з основними і амфотерними оксидами, основами та солями.
1. Дисоціація кислоти (сильний електроліт):
HNO3 ![]() H+ + NO3-
H+ + NO3-
2. Взаємодія з основами:
KOH + HNO3 = KNO3 + H2O
3. Взаємодія з оксидами металів:
CaO + 2HNO3 = Ca (NO3)2 + H2O
4. Взаємодія із солями:
K2CO3 + 2HNO3 = 2KNO3 + CO2 + H2O
5. Розклад нітратної кислоти:
4HNO3 = 2H2O + 4NO2 + O2
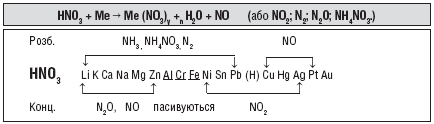
6. Взаємодія з металами (розбавлена й концентрована):
Me + HNO3 ![]() Me(NO3)х +... + H2O
Me(NO3)х +... + H2O
(NH4NO3, N2, N2O, NO, NO2 )
Fe, Al, Cr — на холоді пасивує концентрована HNO3.
Au, Pt — не реагують.
Наприклад, внаслідок взаємодії розбавленої нітратної кислоти з лужними та лужноземельними металами може утворюватися NH4NO3 або N2O наприклад:
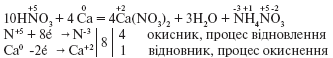
Внаслідок взаємодії концентрованої нітратної кислоти з лужними та лужноземельними металами може утворюватися N2O, наприклад:
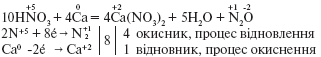
Використані матеріали:
https://www.youtube.com/watch?v=MhScdk_I6EY
Нітрати.
Солі нітратної кислоти називають нітратами. Нітрати можна добути внаслідок дії нітратної кислоти на метали, основні оксиди, основи, аміак і деякі солі, наприклад:
Cu + 4HN03 = Cu(N03)2 + 2N02↑ + 2Н20
CaO + 2HN03 = Ca(N03)2 + H20
Mg(OH)2 + 2HN03 = Mg(N03)2 + 2H20
NH3 + HN03 = NH4N03
Na2C03 + 2HN03 = 2NaN03 + C02↑+ H20
Нітрати лужних металів, кальцію і амонію ще називають селітрами, наприклад: KNO3 – калієва селітра; NaNO3 – натрієва (чилійська) селітра; Ca(NO3)2 – кальцієва (норвезька) селітра; NH4NO3 – аміачна селітра.
Всі нітрати – тверді кристалічні речовини, добре розчинні у воді, малостійкі при високій температурі. На відміну від хлоридів, які плавляться, не розкладаючись, нітрати розкладаються при температурі близькій до температури їх плавлення. Продукти розкладання бувають різні, залежно від хімічної активності металу, що входить до складу солі. Розклад нітратів можна зобразити схемою:
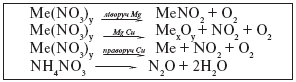
Наприклад:
1. Солі металічних елементів до Mg при розкладанні утворюють нітрити і кисень:
2NaNO3 → 2NaNO2 + O2.
2. Солі металічних елементів від Mg до Cu при розкладанні утворюють основний оксид, нітроген(IV) оксид і кисень:
2Cu(NO3)2 → 2CuO + 4NO2 + O2.
3. Солі металічних елементів розташованих в ряду активності металів після Cu утворюють метал, нітроген оксид і кисень:
2AgNO3 → 2Ag + 2NO2 + O2.
Якісна реакція на нітрат-йон
Нітратна кислота і нітрати містять нітрат-іон NO3–. Для визначення нітрат-іона NO3– у пробірку вміщують трішки досліджуваної речовини, добавляють мідних ошурків, вливають концентрованої сульфатної кислоти і нагрівають. Виділення бурого газу NO2 свідчить про наявність нітрат-іонів.
Схематично це можна зобразити так:
![]()
Наприклад:
KNO3 + H2SO4 → KHSO4 + HNO3(k)
4HNO3 + Cu → Cu(NO3)2 + 2NO2↑ + 2H2O
Застосування
Нітратна кислота є одним з найважливіших продуктів хімічної промисловості. Вона виробляється у дуже великих кількостях, використовується для виробництва азотних добрив, у кольоровій металургії для розділення металів, а також хімічній промисловості для виробництва пластмас, вибухових речовин, целулоїду і фотокіноплівки, штучного волокна, органічних барвників, лікувальних речовин тощо.
Застосування нітратів
- Нітрати використовують переважно як добрива.
- Нітрати лужних металів використовують як компоненти ракетного палива.
- KNO3 використовують для виробництва чорного пороху.
- KNO3, NaNO3 – у малих кількостях використовують для виробництва м’ясних продуктів, деяких сортів сиру (надають м’ясним продуктам червоно-коричневого кольору).
- AgNO3 – для виробництва дзеркал, в гальванотехніці, в аналітичній хімії, невеликі дози в медицині як в’яжучий і бактерицидний засіб.
- Ba(NO3)2, Sr(NO3)2, Pb(NO3)2 – у піротехніці.
Проблема вмісту нітратів у харчових продуктах
Через застосування інтенсивних технологій вирощування рослин, які передбачають використання великої кількості мінеральних добрив, нітрати накопичуються у продуктах. Багато нітратів у ковбасах, молоці, 80% нітратів потрапляє в організм із рослин. Їх більше у ранніх овочах, овочах захищеного ґрунту. Високий вміст нітратів містить редис, редька, дині, кабачки, яблука, буряк.
Самі нітрати не отруйні, але в організмі вони перетворюються на отруйні речовини – нітрити, які взаємодіють з гемоглобіном крові окиснюючи Fe2+ до Fe3+. Замість гемоглобіну утворюється метгемоглобін, який втрачає червоне забарвлення і набуває темно-коричневого кольору. Метгемоглобін не здатний переносити кисень. Виникає киснева недостатність, порушується тканинне дихання. Як наслідок виникають ерозивні гастрити, порушення діяльності щитовидної залози, серцево-судинної системи. Крім того, під дією нітритів в організмі утворюються канцерогенні речовини, що спричиняють онкологічні захворювання. Найбільш чутливі до нітритів діти, хворі та люди старшого віку.
Зменшити кількість нітратів можна, якщо овочі, плоди перед вживанням ретельно промити гарячою водою, після чого яблука, огірки почистити, а з моркви вирізати серцевину. Зниження шкідливого впливу на організм нітратів і нітритів сприяє вживання вітамінів, особливо А, Е, В9.
Використані джерела:
Підручник для 10 класу загальноосвітніх навчальних закладів (
http://edufuture.biz/
http://subject.com.ua/lesson/chemistry/10klas/10.html
http://www.chemistry.in.ua/grade-10/nitrates
https://uk.wikipedia.org/wiki/




Немає коментарів:
Дописати коментар