https://read.bookcreator.com/NExhEHffgUUIgmg6ooKUvKyk9Ms1/EoSSaDMOTmSNSHO0jdLkPA
Дорогі друзі! Я рада всім відвідувачам мого блогу. Це означає, що ви любите чи хочете краще знати не тільки хімію, а й таємниці природи. Сподіваюся, що наша співпраця буде плідною. Успіхів вам!
Сторінки
- Головна сторінка
- ПОРТФОЛІО
- Опис досвіду - ПРОБЛЕМНА ТЕМА
- Розробки уроків хімії
- ПРЕЗЕНТАЦІЇ з ХІМІЇ
- Позакласні заходи
- Мої проекти
- МЕТОДИЧНА СКАРБНИЧКА
- Інтерактивна гра "Класи неорганічних сполук "
- Батькам на замітку
- Світ моїх захоплень
- Готуємось до олімпіад з хімії
- Оновлена ПРОГРАМА з хімії 7 - 9 кл.(2017 р.) .
- Оновлена НАВЧАЛЬНА ПРОГРАМА з ХІМІЇ ,10-11 КЛ.
- Календарно- тематичне планування, Програми з хімії
- КАБІНЕТ ХІМІЇ -все для роботи
- Методичні рекомендації про викладання хімії у 2022/2023 навчальному році
- Критерії оцінювання навчальних досягнень учнів з хімії
- Тематичні тренувальні тести для підготовки до ЗНО з хімії
- Підручники з хімії
- Цифрові інструменти для вчителя
понеділок, 30 січня 2023 р.
неділю, 29 січня 2023 р.
четвер, 26 січня 2023 р.
Поширення та колообіг Оксигену в природі
Поширення та колообіг Оксигену в природі
Оксиген – найпоширеніший на Землі елемент. За числом атомів у земній корі, він займає I місце (47%), і II місце в атмосфері та гідросфері. Атоми Осигену входять до складу води, піску, глини, вапняків, мінералів, кислот, вуглекислого газу, багатьох гірських порід і мінералів, міститься у білках, жирах і вуглеводах, з яких складаються живі організми. У тілі дорослої людини масова частка цього елемента становить приблизно 65%. Підраховано, що в організмі людини вагою 70 кг маса Оксигену становить близько 43 кг.
Зелена кора дерев містить 50% Оксигену, пісок – 53%, глина – 56%, вода – 89%, людський організм – 65%
Кисень міститься у повітрі (23,5% за масою і 21,5% за об’ємом), разом з іншими елементами утворює земну кору, розчинений у природній воді. Він необхідний для дихання, підтримує горіння.
Колообіг Оксигену в природі
Процес, у якому хімічний елемент багаторазово змінює своє місцезнаходження і, врешті, знову повертається в те ж середовище, з якого він вийшов, називається колообігом хімічного елемента. За участю рослин і тварин у природі відбувається колообіг Оксигену, що забезпечує постійний вміст його у повітрі. Головними постачальниками кисню на Землі є зелені рослини, в яких на світлі відбувається процес фотосинтезу. Зелені рослини вбирають вуглекислий газ і воду, а виділяють кисень. Тварини і в темний період доби рослини поглинають для дихання виділений в процесі фотосинтезу кисень. Кисень витрачається також на процеси гниття, які постійно відбуваються у природі, на різноманітну господарську діяльність людини і саме життя на Землі. Підраховано, що рослини нашої планети щороку виділяють в атмосферу 5 • 1011 т кисню. Проте цієї кількості достатньо тільки для компенсування його витрат. Ось чому так важливо зберігати і постійно розширювати зелені насадження, тоді загальна маса кисню в природі помітно змінюватися не буде. У результаті процесів гниття органічні речовини відмерлих рослин і тварин перетворюються на мінеральні речовини, вуглекислий газ і воду. Вуглекислий газ поступає в повітря і знову поглинається зеленими рослинами, а мінеральні речовини – в ґрунт й служать будівельним матеріалом для росту рослин.
За добу людина споживає понад 4 м3 кисню. Неважко підрахувати, яка кількість кисню необхідна для всіх жителів Землі.
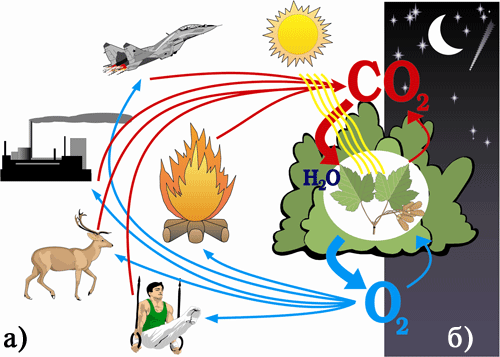
Рис. 75. Колообіг Оксигену: а) світлова стадія фотосинтезу та використання кисню; б) темнова стадія фотосинтезу
Біологічна роль Оксигену
Кисень – життєво важливий майже для всіх організмів, бо він бере участь у процесах дихання. У процесі дихання організм поглинає кисень і виділяє вуглекислий газ. Кисень потрапляє у клітини і забезпечує перебіг реакцій окиснення органічних речовин. При цьому виділяється енергія, необхідна для підтримання всіх життєвих процесів. Продукти окиснення (вуглекислий газ і вода) виводяться з організму. Без кисню неможливий обмін речовин в організмі. Для підтримання життя він необхідний постійно. Якщо людина без їжі може прожити більше місяця, без води – 7-10 днів, то без кисню в її організмі настають незворотні зміни вже через 5-7 хвилин.
Більшість живих організмів пристосувалися до дихання повітрям, до складу якого входить 20-21% кисню. Надлишок кисню, як і його нестача, негативно впливають на їхній стан.
Під час дихання людина засвоює лише 1/5 кисню, що міститься у вдихуваному повітрі; решта ж (4/5) – повертається в атмосферу з видихом.
Найінтенсивніше дихають молоді органи і тканини, які активно ростуть. Людям, які вперше ідуть високо в гори, добре відома «гірська хвороба». Концентрація кисню в повітрі мало змінюється, але в горах понижений тиск, повітря розріджене і в кров не потрапляє необхідної кількості кисню, настає кисневе голодування.
Перша реакція на кисень позитивна, але чистий кисень – це отрута для людини і тварин. Миші у кисні гинуть через 3-5 днів, а патологічні зміни в організмі настають уже в перші години.
У людей спочатку набрякають легені, погіршується надходження кисню в кров, відтак настає кисневе голодування. У рослин він гальмує процеси фотосинтезу і росту.
Водолази можуть опускатися з кисневими балонами завглибшки близько 20 метрів. Якщо опуститися глибше, починаються конвульсії, запаморочення, непритомність і настає смерть через кисневе отруєння.
Застосування кисню
Широке застосування кисню ґрунтується на його властивості підтримувати горіння, процеси окиснення та забезпечувати дихання.
Рис. 76. Застосування кисню: 1 – для дихання в особливих умовах (в авіації, на підводних роботах, хворим); 2 – для зварювання металів; 3 – для різання металів; 4 – у металургії і промисловості; 5 – на підривних роботах; 6 – окиснення палива у двигунах внутрішнього згоряння: в автомобілях, літаках; 7 – у медицині
У хімічній промисловості кисень використовується як окисник під час виробництва нітратної і сульфатної кислот, добування органічних речовин тощо.
У чорній і кольоровій металургії – для прискорення виплавки чавуну і сталі, прискорення процесів горіння, досягнення вищої температури полум’я.
Застосовують кисень й у спеціальних пристроях для зварювання та різання металів. Температура киснево-ацетиленового полум’я сягає +3500ºС, а киснево-водневого – +3000ºС.
Пористі горючі матеріали, наприклад, тирса, сухий мох, кокс, просочені рідким киснем, згоряють в одну мить. Якщо вони згоряють у замкнутому просторі, то гарячі стиснені гази, що утворюються під час горіння, спричинюють великі руйнування. Тому суміші пористих горючих матеріалів з рідким киснем застосовують при видобуванні руди, у будівельній справі, будівництві тунелів, гідроелектростанцій, під час прокладання залізничних колій, як вибухівку.
Як окисник у ракетних двигунах використовують рідкий кисень.
Кисень використовується для полегшення дихання хворих людей, під час виконання водолазами підводних робіт, під час гасіння пожеж, у польотах льотчиками та космонавтами, тощо.
Підсумок
- Оксиген – найпоширеніший елемент на Землі.
- Колообіг Оксигену в природі забезпечує наявність життя на Землі.
?
- Що таке колообіг хімічного елемента?
- Що вам відомо про колообіг Оксигену в природі?
- Яке практичне застосування кисню?
- Яку роль відіграє Оксиген у живій природі?
- Що спільного у горінні простих і складних речовин?
- Чому пілоти, піднімаючись у височінь, беруть балони з киснем?
- Де трапляється Оксиген у вільному стані?
- До складу яких природних сполук входить Оксиген?
- Яку роль відіграє кисень у житті живих організмів?
Для допитливих
Чому саме 21% кисню міститься в повітрі? Якби кисню було, наприклад, 15%, горіння було б неможливим. А якби його було 30%, то перша блискавка спалила б усе живе. У таких умовах легко горіла б навіть мокра деревина.
ТОП цікавих фактів про метали
ТОП цікавих фактів про метали
Всі метали можуть існувати як у твердій формі, так і рідкій або навіть газоподібній . Все залежить від умов навколишнього середовища – якщо, наприклад, залізо або золото нагріти досить сильно, воно випарується, прийнявши газоподібну форму.
Усім, напевно, знайомі ртутні градусники, але не всі знають, що ртуть – це також метал. Просто в неї дуже низька температура плавлення, вона плавиться і перетворюється на рідину вже при -38,83°C. На Півночі взимку ртутні термометри часто замерзають, тому там у ходу більше електронні.
Цінність деяких металів згодом сильно змінюється. Іспанські конкістадори, відкривши в Новому Світі платину, спочатку не вважали її цінною, а за часів Наполеона звичайнісінький алюміній цінувався куди дорожче за золото.
Найчастіше інших металів у промисловості використовуються залізо, алюміній та мідь. Саме з міді та алюмінія виготовляють дроти та кабелі, тому що вони з мінімальним опором проводять електричний струм. Срібло, щоправда, перевершує їх за цим параметром, але воно коштує дорожче.
Метали окислюються під впливом кисню. Тому всі металеві деталі, що вирушають у космос, проходять попередній процес окислення, щоб на них утворилася плівка оксидів. Якщо цього не зробити, “голі” металеві частини при дотику просто приваряться одна до одної.
Алюміній є найпоширенішим металом у земній корі, а серед взагалі всіх хімічних елементів він займає третє місце, поступаючись лише кисню та кремнію.
На інших планетах йдуть дощі з заліза та інших металів, які присутні у їхніх атмосферах у газоподібному стані. Зрозуміло, це можливо тільки на тих планетах, атмосфери яких розпечені до сотень та тисяч градусів.
У Сонячній системі є одна планета, на якій деякі метали можуть бути присутніми у навколишньому середовищі в рідкому стані у помітних кількостях. Це Венера, середня приповерхнева температура якої (462 °C) перевищує температуру плавлення свинцю 327,5 °C.
Спочатку європейські завойовники, що прибули в Америку, визнали платину “підробленим сріблом”, і великі її запаси просто втопили в океані, щоб уникнути фальшивомонетництва.
Найдорожчий метал у світі – каліфорній, який у природі у природному вигляді не зустрічається. Вперше його вдалося отримати в лабораторних умовах у 1950 році, щорічно виробляється всього 40-60 міліграм каліфорнію і вартість одного грама доходить до 4 млн. доларів.
Крім золота, срібла та платини, у світі існують інші цінні та затребувані метали, такі, як паладій та іридій.
Незважаючи на те, що на алюміній припадає близько 8,6% маси земної кори, у природі він зустрічається у вигляді домішок до інших мінералів. У чистому вигляді його іноді у незначних кількостях виявляють лише у жерлах вулканів. Алюміній був одним з найдорожчих у світі (дорожче, ніж золото!) металів до 1886 року. Але цього року було відкрито економічно вигідний спосіб його отримання і він упав у ціні в сотні разів.
Багато металів, включаючи найсучасніші сорти сталі, уразливі перед кислотами, але не всі. Тантал та іридій, наприклад, взагалі не бояться кислоти, їх не здатна розчинити навіть “царська горілка”, концентрована суміш азотної та соляної кислот.
В акумуляторах більшості смартфонів та інших подібних аксесуарів можна знайти літій. Цей метал є найлегшим у світі і він відрізняється надзвичайною м’якістю, його можна легко зім’яти, просто стиснувши у кулаку.
У світі вже давно і широко використовується титан, але, незважаючи на його властивості, в машинобудуванні використовується лише близько 7% світового видобутку. Близько 60% йде на виробництво фарби, 13% споживає паперова промисловість, а 20% використовується при виготовленні пластику.
Уран – дорогий та затребуваний радіоактивний метал, який використовується в ядерних реакторах. Вчені встановили, що близько 80% запасів уранової руди на Землі зосереджено в одній-єдиній країні, Демократичній Республіці Конго, яка і досі залишається однією з найбідніших в Африці.
Найтугоплавкіший метал у світі – вольфрам, він плавиться при температурі +3422 °C, а закипає і починає випаровуватися при нагріванні до +5900 °C. Для порівняння температура поверхні Сонця становить приблизно +5505 °C.
У воді морів та океанів Землі розчинена взагалі вся таблиця Менделєєва, включаючи всі метали, від урану до платини. Але промисловий видобуток їх з води економічно невигідний.
Найдорожчим металом, що зустрічається в природі у природному вигляді, є не золото чи платина, а родій. Цікаво, що він трапляється здебільшого у вигляді домішок до золотих та платинових родовищ. У середньому на рік у світі видобувається близько 28-30 тонн родію.
Всі знають запах заліза, але свої запахи мають і деякі інші метали. Осмій, наприклад, пахне, як дивна суміш часнику та хлорки – аромат досить дивний.
Шляхетні метали, такі як платина, золото, паладій та інші, не вступають у реакцію з людським тілом, тому їх широко використовують у медицині та ювелірній справі. Згідно з офіційним визначенням, до благородних металів належать ті з них, що не взаємодіють з соляною кислотою, не окислюються. Традиційно до цього списку включають золото, срібло, платину, осмій, іридій, паладій, родій та рутеній.
Заліза на Землі видобувається і обробляється більше, ніж будь-якого іншого металу. Щогодини з земних надр витягується більше заліза, ніж було видобуто золота протягом історії.
З усіх чистих металів, що не містять домішок, хром є єдиним досить недорогим, щоб його можна було широко використовувати. Він, до речі, досить токсичний, але тільки в тому випадку, якщо, наприклад, вдихати його пилюку або пари.
Метал галій можна легко розтопити, якщо взяти його в руку. При кімнатній температурі він зберігає тверду форму, але температура плавлення становить +29,6 °C, що нижче нормальної температури людського тіла в +36,6 °C.
Вчені давно втілили в життя мрію алхіміків Середньовіччя, навчившись отримувати золото з ртуті. Правда, це дорого й економічно невигідно, до того ж у процесі бере участь радіоактивне випромінювання, так що золото, що виходить у результаті, теж виявляється радіоактивним.
Ртуть легко роз’їдає алюміній, руйнуючи плівку оксидів на ньому. Простіше кажучи, ртуть може, подібно до кислоти, зробити дірку в алюмінієвій пластині, так що її в жодному вигляді не можна перевозити в літаках, тому що їх корпуси виготовляються з алюмінію.
Золото дуже м’яке саме по собі і в ювелірній промисловості воно зазвичай використовується у сплаві з іншими металами, які надають йому міцності. Хоча в деяких країнах, наприклад, у Таїланді, золото 585 чи там 750 проби навіть за золото не рахується.
Через техногенного впливу людської цивілізації весь світ зараз трохи більш радіоактивний, ніж кілька століть тому. Коли американці вирішили запустити на орбіту супутник для виміру космічної радіації, вони виявили, що не можуть досягти потрібної точності приладів, тому що всі метали, з яких супутник зроблен, самі по собі випромінює нікчемні дози радіації. Їм навіть довелося добути “чистий” метал з корпусу корабля, що затонув у 1919 році – як виявилося, він зовсім не радіоактивний, тому що його весь цей час захищала водяна товща.
Джерело: https://interes-fakti.com/cikavi-fakti-pro-metal/
Цікаво та пізнавально про СПЛАВИ
Мідь - один з перших металів, які людина почала застосовувати для технічних цілей. Разом з золотом, сріблом, залізом, оловом, свинцем і ртуттю, мідь відома людям з найдавніших часів і зберігає своє важливе технічне значення до теперішнього часу.
2.Мідь – це пластичний, рожево-червоний метал з металевим блиском. Мідь володіє високою пластичністю і корозійною стійкістю, високою електропровідністю. Електропровідність міді в 1,7 рази вище, ніж у алюмінію і теплопровідністю, а також стійкістю проти атмосферної корозії. На повітрі мідь покривається щільною зелено-сірою плівкою основного карбонату, яка захищає її від подальшого окислення. При високих температурах мідь сильно окислюється .


Температура плавлення міді 1083 ° С, температура кипіння 2567°С.. Завдяки високій пластичності мідь добре обробляється тиском (з міді можна зробити фольгу товщиною 0,02 мм), але через високу в'язкість погано піддається різанню. Мідь задовільно зварюється та добре паяється.
3. Мідь маркують буквою М, після якої стоїть цифра. Чим більше цифра, тим більше в ній домішок. Найвища марка М00 - 99,99% міді, М4 - 99% міді.
Цей метал застосовується в багатьох галузях промисловості, у чистому вигляді широко застосовується в електротехніці та приладобудуванні.
Застосування в локомотивах: обмотки трансформаторів , обмотки генераторів ТЕД, контакти реле та апаратів.
4. На зміну мідно-кам'яному вікові прийшов бронзовий (II — поч. І тис. до Н. X.), істотною рисою якого було поширення виробів з бронзи — першого штучно створеного людиною металевого сплаву. Перегляд відеоролику «Бронзовий вік» (1 хв)
Винайдений метал був міцніший за мідь, мав меншу температуру плавлення, що значно спростило технологію обробки (його можна було виплавляти в примітивних печах або на звичайних вогнищах). Ці переваги сприяли поширенню та утвердженню бронзи як основного матеріалу для виготовлення знарядь праці, зброї, прикрас.
Бронзами називають сплави міді з оловом, а також з алюмінієм, свинцем, берилієм, кремнієм, хромом або іншими елементами. Частка олова у бронзах може становити від 1,25 до 10 %. Серед неметалічних сполук найчастіше до складу бронзи входить фосфор. Типова бронза має склад: 94,65 % — мідь, 5 % — олово, 0,35 % — фосфор. Фосфор надає бронзам додаткової пружності, твердості, та збільшує стійкість до корозії. Температура плавлення бронзи перебуває в межах 990…1190 °С
.

5. Бронзи мають хороші ливарні і високі антифрикційні властивості, а також оброблюваність різанням. Більшість бронз мають достатньо високу корозійну стійкість. Вони використовуються при виготовленні арматури газових і водопровідних ліній і в хімічному машинобудуванні, де важлива також висока корозійна стійкість бронз.
Залежно від назви основного легуючого компонента бронзи поділяють на олов'яні, алюмінієві, кремнієві, свинцеві, берилієві і т.д.
Олов’яні бронзи – це сплави міді з оловом та іншими елементами: Zn, Pb, Ni, P. Бронзи з вмістом 6%Sn не піддаються деформуванню і їх використовують у литому стані. Характерною особливістю олов’яних бронз є дуже мала усадка, тому їх використовують для отримання найбільш складних за конфігурацією відливків
Алюмінієві бронзи – це сплави міді з алюмінієм, які додатково можуть бути леговані Ni, Mn, Fe та ін. Вони мають добрі технологічні і механічні властивості. З алюмінієвих бронз виготовляють литтям і обробкою тиском відповідальні деталі машин: шестерні, втулки, фланці.
Кремнієві бронзи – це сплави міді з кремнієм. Їх застосовують як замінник олов’яних бронз. Вони характеризуються більшою усадкою, ніж олов’яні бронзи, вищими корозійною стійкістю і механічними властивостями, а також високою пружністю.
Берилієві бронзи – це сплави міді з берилієм. Вони характеризуються високими механічними, зокрема, пружними властивостями, стійкістю проти корозії. Застосовують берилієві бронзи для виготовлення пружин, мембран, слюсарного інструменту та ін.
Свинцеві бронзи – це сплави міді зі свинцем. Вони використовуються як антифрикційний матеріал у підшипниках ковзання.
Хромові бронзи – це сплави міді з хромом. Вони мають високі механічні властивості, добру електро- і теплопровідність
Цирконієві бронзи – це сплави міді з цирконієм. Вони мають високу електро- і теплопровідність, що наближаються до аналогічних характеристик міді, і жароміцність. Хромові і цирконієві бронзи застосовують у двигунобудуванні.
За технологічною ознакою бронзи, як інші сплави кольорових металів (алюмінієві, титанові, магнієві сплави), підрозділяють на:
Ливарні (з ливарних бронз виготовляють переважно арматуру, а також деталі, що працюють в умовах тертя (втулки, вкладки підшипників, вінці черв'ячних коліс).
Деформівні

Бронзи маркуються літерами Бр. Легуючі елементи позначаються початковою літерою назви цього елемента: А — алюміній, Б — берилій, Ж — залізо, К — кремній, Мг — магній, Мц — марганець, Н — нікель, О — олово, С — свинець, Ф — фосфор, Ц — цинк За буквами вказується вміст легуючих елементів у процентах.


Малий коефіцієнт тертя і стійкість до зношування робить бронзи незамінними при виготовленні вкладишів підшипників, черв’яків і черв’ячних коліс, шестерень і інших деталей відповідальних і точних приладів. В локомотивах бронза використовується в підшипниках колінвалу, турбокомпресорів, нагнітачів повітря.
6. Латуні – це мідні сплави, в яких основним легуючим елементом є цинк. При вмісті цинку до 39% латуні мають високу пластичність, добре оброблюються тиском при низьких і високих температурах. При вмісті Zn>39% латуні мають підвищену міцність і твердість, але низьку пластичність.
Для підвищення механічних властивостей та хімічної стійкості латуней до них часто додають легуючі елементи: Al, Ni, Mn, Si, Sn тощо. Al, Mn, Fe, Si підвищують міцність і твердість латуні, однак при цьому знижують її пластичність. Al, Mn, Sn, Ni підвищують корозійну стійкість латуней.


За
технологічною ознакою латуні поділяються
на ті, що деформуються та ливарні. Латуні,
що деформуються, використовують для
виготовлення виробів і напівфабрикатів
обробкою тиском. Ливарні латуні
використовуються для фасонного лиття.
Це в основному складнолеговані сплави.
Легуючі елементи впливають на ливарні
властивості латуней по різному.
Наприклад, Fe,
Mn знижують
рідкотекучість, а Sn (до
2,5%) підвищує її. Використовується
латунь локомотивах - в корпусах
щіткоутримувачів електричних машин,
генераторів.
Куніали (мідь – нікель – алюміній) використовують для виготовлення деталей підвищеної міцності, пружин та інших електротехнічних виробів.
Нейзильбери (мідь – нікель – цинк) мають колір близький до срібла. Вони добре протистоять атмосферній корозії. Їх використовують в приладобудуванні та при виробництві годинників.
Мельхіори (мідь – нікель та незначна кількість добавки заліза і марганцю) дуже корозієстійкі, навіть у морській воді. Їх використовують для виготовлення теплообмінних апаратів, ювелірних виробів тощо.
Копелі (мідь – нікель (43%) – марганець (0,5%)) – спеціальний термоелектричний сплав для виготовлення термопар.
Манганін (мідь – нікель (3%) – марганець (12%)) – спеціальний сплав з високим питомим електричним опором. Використовується для виготовлення електронагрівальних елементів.
Константани (мідь – нікель (40%) – марганець (1,5%)) – застосовуються для виготовлення електронагрівальних елементів.
Абісинське золото — стійкий до корозії мідний сплав, що імітує золото за кольором; містить 88% Cu, 11,5% Zn і 0,5% Au[1]. Додавання 0,5% Au сприяє тривалішому збереженню блиску без потемніння.
Назву сплав отримав через те, що вперше був створений в Абісинії (Ефіопії). Широко використовувався у XIX-му столітті для виготовлення ювелірних виробів (біжутерії).
Моне́ль (монель-метал) — високоміцний корозійностійкий нікелевий сплав, що містить 27…29% Cu, 2…3% Fe, 1,2…1,8% Монель характеризується:
• високою корозійною стійкістю в морській воді і хімічних апаратах;
• відсутністю корозійного розтріскування;
• добрими механічними властивостями до температур близько 550 °C;
• доброю оброблюваністю і зварюваністю.
Спекулум — сріблястий сплав олова та бронзи.
Томпа́к або бакунт — різновид латуні з вмістом міді 88—97 % і цинку до 10%. Має високу пластичність, антикорозійні й антифрикційні властивості.
Добре зварюється зі сталлю й благородними металами. Має високу корозійну стійкість,підвищену пластичність, легко обробляється тиском у гарячому та холодному стані.
Томпак використовують для виготовлення радіаторних трубок, художніх виробів, та фурнітури.
Сучасне металургійне виробництво і його продукція
Сучасне металургійне виробництво і його продукція
Сучасним металургійним виробництвом (рис. 1.1) є комплекс різних виробництв, що базуються на родовищах руди і вугілля, що коксується, енергетичних комплексах.

Рисунок 1.1 - Структура сучасного металургійного виробництва
Воно включає:
- шахти і кар'єри по здобичі рудий і кам'яного вугілля;
- гірничо-збагачувальні комбінати, де збагачують руди, готуючи їх до плавки;
- коксохімічні заводи (підготовка вугілля, їх коксування і витягання з них корисних хімічних продуктів);
- енергетичні цехи для отримання стислого повітря (для дуття доменних печей), кисню, очищення металургійних газів;
- доменні цехи для виплавки чавуну і феросплавів або цехи для виробництва залізорудних металізованих котунів;
- заводи для виробництва феросплавів;
- сталеплавильні цехи (конвертерні, мартенівські, електросталеплавильні);
- прокатні цехи (злиток в сортовий прокат).
Основна продукція чорної металургії:
- чавуни: переробний, використовуваний для перероблювання на сталь, і ливарний, для виробництва фасонних відливок;
- залізорудні металізовані котуни для виплавки сталі;
- феросплави (сплави заліза з підвищеним вмістом марганцю, кремнію, ванадію, титану і так далі) для легованих сталей;
- сталеві злитки для виробництва прокату
- сталеві злитки для виготовлення крупних кованих валів, дисків (ковальські злитки).
Основна продукція кольорової металургії:
- злитки кольорових металів для виробництва прокату;
- злитки для виготовлення відливань на машинобудівних заводах;
- лігатури – сплави кольорових металів з легуючими елементами для виробництва складних легованих сплавів;
- злитки чистих і особливо чистих металів для приладобудування і електротехніки.
1.2. Матеріали для виробництва металів і сплавів
Для виробництва чавуну, стали і кольорових металів використовують руду, флюси, паливо, вогнетривкі матеріали.
Промислова руда (рис. 1.2,а) – гірська порода, з якої доцільно витягувати метали і їх з'єднання (вміст металу в руді має бути не менше 30-60 % для заліза, 3-5% для міді, 0,005-0,02 % для молібдену).
Руда складається з мінералів, що містять метал або його з'єднання, і порожньої породи. Називають руду поодинці або декількома металами, що входять в їх склад, наприклад: залізні, мідно-нікелеві.
Залежно від змісту елементу, що здобувається, розрізняють руди багаті і бідні. Бідні руди збагачують – видаляють частину порожньої породи.

Рисунок 1.2 – Матеріали для виробництва металів і сплавів: а - промислові руди (червоний залізняк (гематит), бурий залізняк (лимонит), магнітний залізняк (магнетит); б - флюси (доломіт, вапняк); в - паливо (кокс)
Флюс (рис. 1.2,б) – матеріал, що завантажуються в плавильну піч для утворення легкоплавкого з'єднання з порожньою породою руді або концентратом і золою палива. Таке з'єднання називається шлаком.
Зазвичай шлак має меншу щільність, чим метал, тому він розташовується над металом і може бути видалений в процесі плавки. Шлак захищає метал від пічних газів і повітря. Шлак називають кислим, якщо в його складі переважають кислотні оксид, і основним, якщо в його складі більше основних оксидів.
Паливо – в металургійних печах використовується кокс (рис. 1.2,в), природний газ, мазут, доменний (колошниковий) газ.
Кокс отримують сухою перегонкою при температурі 1000 0С (без доступу повітря) кам'яного вугілля сортів, що коксуються. У коксі міститься 80-88 % вуглецю, 8-12 % золи, 2-5 % волога. Шматки коксу повинні мати розміри 25-60 мм. Це міцне паливо, що не спікається, служить не тільки пальним для нагріву, але і хімічним реагентом для відновлення заліза з руди.
Вогнетривкі матеріали застосовують для виготовлення внутрішнього облицювального шару (футерування) металургійних печей, тиглів і ковшів для розливки металу.
Вони здатні витримати навантаження при високих температурах, протистояти різким змінам температури, хімічній дії шлаку і пічних газів.
По хімічних властивостях вогнетривкі матеріали розділяють на групи: кислі (кварцовий пісок, динасова цегла), основні (магнезитова цегла, магнезитохромиста цегла), нейтральні (шамотна цегла).
Взаємодія основних вогнетривких матеріалів і кислих шлаків може привести до руйнування печі.
Вуглецева цеглина і блоки містять до 92 % вуглецю у вигляді графіту, володіють підвищеною вогнетривкістю. Застосовуються для кладки лещаді доменних печей, електролізних ванн для отримання алюмінію, тиглів для плавлення і розливання мідних сплавів.
1.3. Виробництво чавуну
Чавун – сплав заліза і вуглецю з супутніми елементами (зміст вуглецю більше 2,14 %).
Для виплавки чавуну в доменних печах використовують залізняк, паливо, флюси.
До залізняку відносяться:
- магнітний залізняк із змістом заліза 55-60 %, родовища – Соколовське, Курська магнітна аномалія (КМА);
- червоний залізняк із змістом заліза 55-60 %, родовища – Кривий Ріг, КМА;
- бурий залізняк (гідрати оксидів заліза 2Fe2O3 * 3H2O і Fe2O3 * H2O) із змістом заліза 37-55 % – Керч.
Марганцеві руди застосовуються для виплавки сплаву заліза з марганцем – феромарганцю (10-82%), а також переробних чавунів, що містять до 1% марганцю. Марганець в рудах міститься у вигляді оксидів і карбонатів і інших сполуках.
Хромові руди застосовуються для виробництва ферохрому, металевого хрому і вогнетривких матеріалів – хромомагнезитів.
Паливом для доменної плавки служить кокс, можлива часткова заміна газом, мазутом.
Флюсом є вапняк або доломитизований вапняк, що містить і, оскільки в шлак повинні входити основні оксиди, які необхідні для видалення сірі з металу.
Підготовка руди до доменної плавки здійснюється для підвищення продуктивності доменної печі, зниження витрати коксу і поліпшення якості чавуну.
Метод підготовки залежить від якості руди.
Дроблення і сортування руди необхідно для отримання шматків оптимальної величини, здійснюються за допомогою дробарок і класифікаторів.
Збагачення руди засноване на відмінності фізичних властивостей мінералів, що входять в її склад:
- промивка – відділення щільних складових від порожньої рихлої породи;
- гравітація (відсадження) – відділення руд від порожньої породи при пропусканні струменя води через дно вібруючого сита: порожня порода витісняється у верхній шар і несеться водою, а рудні мінерали опускаються;
- магнітна сепарація – подрібнену руду піддають дії магніту, що притягає залізовмісні мінерали і що відокремлює їх від порожньої породи.
Окускування проводять для переробки концентратів в кускові матеріали необхідних розмірів. Застосовують два способи окускування: агломерацію і обкочування.
При агломерації шихту, що складається із залізняку (40-50 %), вапняку (15-20 %), повернення дрібного агломерату (20-30 %), коксової дрібниці (4-6 %), вологи (6-9 %), спікають на агломераційних машинах при температурі 1300-1500 °С. При спіканні з руди відділяються шкідливі домішки (сірка, миш'як), розкладаються карбонати, і виходить кусковий пористий офлюсований агломерат
При обкочуванні шихту з подрібнених концентратів, флюсу, палива зволожують і при обробці в барабанах, що обертаються, вона набуває форми кульок-котунів діаметром до 30 мм. Їх висушують і обпалюють при температурі 1200-1350 °С.
Використання агломерату і котунів виключає окрему подачу флюса – вапняку в домну.
1.4. Виплавка чавуну
Чавун виплавляють в печах шахтного типу – доменних печах.
Суть процесу отримання чавуну в доменних печах полягає у відновленні оксидів заліза, що входять до складу руди оксидом вуглецю, воднем і твердим вуглецем, що виділяється при згоранні палива.
При виплавці чавуну вирішуються завдання:
- Відновлення заліза з оксидів руди, вуглецювання його і видалення у вигляді рідкого чавуну певного хімічного складу.
- Оплавлення порожньої породи руди, утворення шлаку, розчинення в нім золи коксу і видалення його з печі.
Улаштування і робота доменної печі.
Доменна піч (рис.1.3) має сталевий кожух, викладений вогнетривкою шамотною цеглою. Робочий простір печі включає колошник 6, шахту 5, розпарення 4, заплечики 3, сурма 1, лещадь 15.

Рисунок 1.3 – Улаштування доменної печі
У верхній частині колошника знаходиться засипний апарат 8, через який в піч завантажують шихту. Шихту подають у вагонетки 9 підйомника, які пересуваються по мосту 12 до засипного апарату і, перекидаючись, висипають шихту в приймальну воронку 7 розподільника шихти. При опусканні малого конуса 10 шихта потрапляє в чашу 11, а при опусканні великого конуса 13 – в доменну піч, що запобігає виходу газів з доменної печі в атмосферу.
При роботі печі шихтові матеріали, проплавляючись, опускаються, а через завантажувальний пристрій подають нові порції шихти, щоб весь корисний об’єм був заповнений.
Корисний об'єм печі – об'єм, займаний шихтою від лещаді до нижньої кромки великого конуса засипного апарату при його опусканні.
Корисна висота доменної печі (Н) досягає 35 м, а корисний об'єм – 2000.5000 м3.
У верхній частині горна знаходяться фурмені пристрої 14, через яких в пекти поступає нагріте повітря, необхідне для горіння палива. Повітря поступає з повітронагрівача, усередині якого є камера згорання і насадка з вогнетривкої цеглини, в якій є вертикальні канали. У камеру згорання до пальника подається очищений доменний газ, який, згораючи, утворює гарячі гази. Проходячи через насадку, гази нагрівають її і віддаляються через димар. Через насадку пропускається повітря, він нагрівається до температури 1000-1200 °С і поступає до фурменого пристрою, а звідти через фурми 2 – в робочий простір печі.
Горіння палива. Поблизу фурм природний газ і вуглець коксу, взаємодіючи з киснем повітря, згорають:
CO2=CO2Q
CH42O2=CO22H2O(пар)Q
В результаті горіння виділяється велика кількість теплоти, в печі вище за рівень фурм розвивається температура вище 2000 °С.
Продукти згорання взаємодіють з розжареним коксом по реакціях:
CO2C=2CO−Q
H2OC=COH2−Q
Утворюється суміш відновних газів, в якій окисел вуглецю є головним відновником заліза з його оксидів. Для збільшення продуктивності що подається в доменну піч повітря зволожується, що приводить до збільшення змісту відновника.
Гарячі гази, піднімаючись, віддають теплоту шихтовим матеріалам і нагрівають їх, охолоджуючись до 300-400 °С у колошника.
Шихта (агломерат, кокс) опускається назустріч потоку газів, і при температурі близько 570 °С починається відновлення оксидів заліза.
Відновлення заліза в доменній печі.
Відновлення заліза відбувається у міру просування шихти вниз по шахті і підвищення температури від вищого оксиду до нижчого, в декілька стадій:
Fe2O3→Fe3O4→FeO→Fe
Відновниками оксидів заліза є твердий вуглець, оксид вуглецю і водень.
Відновлення твердим вуглецем (коксом) називається прямим відновленням, протікає в нижній частині печі (зона розпарення), де вищі температури, по реакції:
FeOC=FeCO−Q
Відновлення газами називається непрямим відновленням, протікає у верхній частині печі при порівняно низьких температурах, по реакціях:
2Fe2O3CO=2Fe3O4CO2Q
Fe3O4CO=3FeOCO2−Q
FeOCO=FeCO2Q
За рахунок і відновлюються всі вищі оксиди заліза до нижчого і 40.60 % металевого заліза.
При температурі 1000-1100 °C відновлене з руди тверде залізо, взаємодіючи з оксидом вуглецю, коксом і вуглецем сажі, інтенсивно розчиняє вуглець. При насиченні вуглецем температура плавлення знижується і на рівні розпарення і заплечиків залізо розплавляється (при температурі близько 1300 °С).
Краплі залізовуглецевого сплаву, протікаючи по шматках коксу, додатково насищаються вуглецем (до 4%), марганцем, кремнієм, фосфором, які при температурі 1200 °C відновлюються з руди, і сіркою, що міститься в коксі.
У нижній частині доменної печі утворюється шлак в результаті сплаву оксидів порожньої породи, флюсів і золи палива. Шлак утворюється поступово, його склад міняється у міру стікання в сурму, де він скупчується на поверхні рідкого чавуну, завдяки меншій щільності. Склад шлаку залежить від складу вживаних шихтових матеріалів і чавуну, що виплавляється.
Чавун випускають з печі кожні 3-4 години через чавунну льотку 16, а шлак – кожні 1-1,5 години через шлакову льотку 17 (льотка – отвір в кладці, розташований вище лещаді).
Льотку відкривають бурильною машиною, потім закривають вогнетривкою масою. Зливають чавун і шлак в чавуновозні ковші і шлаковозні чаші.
Чавун поступає в киснево-конвертерних або мартенівські цехи, або розливається у виливниці розливною машиною, де він твердне у вигляді чушок-злитків масою 45 кг.
1.5. Продукти доменної плавки
Основним продуктом доменної плавки є чавун.
Переробний чавун призначається для подальшого перероблення в сталь. На його частку доводиться 90 % загального виробництва чавуну. Зазвичай такий чавун містить 3,8-4,4 % вуглецю, 0,3-1,2 % кремнію, 0,2-1 % марганцю, 0,15-0,20 % фосфору, 0,03-0,07 % сірі.
Ливарний чавун застосовується на машинобудівних заводах для отримання фасонних відливок.
Окрім чавуну в доменних печах виплавляють наступні матеріали.
Феросплави – сплави заліза з кремнієм, марганцем і іншими елементами. Їх застосовують для розкислювання і легування сталі.
Побічними продуктами доменної плавки є шлак і доменний газ.
З шлаку виготовляють шлаковату, цемент, добрива (прагнуть отримати гранульований шлак, для цього його виливають на струмінь води).
Доменний газ після очищення використовується як паливо для нагріву повітря, що вдувається в доменну піч.
1.6. Найважливіші техніко-економічні показники роботи доменних печей
Чим нижче КИПО, тим вище продуктивність печі. Для більшості доменних печей КИПО = 0,5-0,7.
- Коефіцієнт використання корисного об'єму доменної печі (КИПО) – це відношення корисного об'єму печі V (м3) до її середньодобової продуктивності Р (т) виплавленого чавуну.
КИПО=VP(м3/т)
- Питома витрата коксу, К – це відношення витрати коксу за добу А(т) до кількості чавуну, виплавленого за цей же час Р(т).
Питома витрата коксу в доменних печах складає 0,5-0,7.
K – важливий показник, оскільки вартість коксу складає більше 50% вартості чавуну.
- К = А/Р
Промислова руда – гірська порода, з якої доцільно витягувати метали і їх з'єднання (вміст металу в руді має бути не менше 30-60 % для заліза, 3-5% для міді, 0,005-0,02 % для молібдену).
Флюс – матеріал, що завантажуються в плавильну піч для утворення легкоплавкого з'єднання з порожньою породою руді або концентратом і золою палива. Таке з'єднання називається шлаком.
Паливо – в металургійних печах використовується кокс, природний газ, мазут, доменний (колошниковий) газ.
Вогнетривкі матеріали застосовують для виготовлення внутрішнього облицювального шару (футерування) металургійних печей, тиглів і ковшів для розливки металу.
По хімічних властивостях вогнетривкі матеріали розділяють на групи: кислі (кварцовий пісок, динасова цегла), основні (магнезитова цегла, магнезитохромиста цегла), нейтральні (шамотна цегла).
Чавун – сплав заліза і вуглецю з супутніми елементами (зміст вуглецю більше 2,14 %).
Для виплавки чавуну в доменних печах використовують залізняк, паливо, флюси.
Паливом для доменної плавки служить кокс, можлива часткова заміна газом, мазутом.
Флюсом є вапняк або доломитизований вапняк, що містить і, оскільки в шлак повинні входити основні оксиди, які необхідні для видалення сірі з металу.
Підготовка руди до доменної плавки здійснюється для підвищення продуктивності доменної печі, зниження витрати коксу і поліпшення якості чавуну.
Окускування проводять для переробки концентратів в кускові матеріали необхідних розмірів. Застосовують два способи окускування: агломерацію і обкочування.
Чавун виплавляють в печах шахтного типу – доменних печах.
Суть процесу отримання чавуну в доменних печах полягає у відновленні оксидів заліза, що входять до складу руди оксидом вуглецю, воднем і твердим вуглецем, що виділяється при згоранні палива.
Основним продуктом доменної плавки є чавун.
Переробний чавун призначається для подальшого перероблення в сталь.
Ливарний чавун застосовується на машинобудівних заводах для отримання фасонних відливок.
Окрім чавуну в доменних печах виплавляють наступні матеріали.
Феросплави – сплави заліза з кремнієм, марганцем і іншими елементами. Їх застосовують для розкислювання і легування сталі.
Побічними продуктами доменної плавки є шлак і доменний газ.
З шлаку виготовляють шлаковату, цемент, добрива (прагнуть отримати гранульований шлак, для цього його виливають на струмінь води).
Доменний газ після очищення використовується як паливо для нагріву повітря, що вдувається в доменну піч.Процеси прямого отримання заліза з руд
Під процесами прямого отримання заліза розуміють такі хімічні, електрохімічні або хіміко-термічні процеси, які дають можливість отримувати безпосередньо з руди, минувши доменну піч, металеве залізо у вигляді губки, криці або рідкого металу.
Сталь – залізовуглецевий сплав, що містять практично до 1,5% вуглецю, при більшому його змісті значно збільшуються твердість і крихкість сталей і вони не знаходять широкого застосування.
Основними початковими матеріалами для виробництва сталі є переробний чавун і сталевий лом (скрап).
Залізо окислюється насамперед при взаємодії чавуну з киснем в сталеплавильних печах:
Процеси виплавки сталі здійснюють в три етапи.
Перший етап – розплавлення шихти і нагріваючи ванни рідкого металу.
Другий етап – кипіння металевої ванни – починається у міру прогрівання до вищих температур.
Третій етап – розкислювання сталі полягає у відновленні оксиду заліза, розчиненого в рідкому металі.
Сталь розкислюють двома способами: осаджуванням і дифузійним.
Осаджуюче розкислювання здійснюється введенням в рідку сталь розчинних розкислювачів (феромарганцю, феросиліцію, алюмінію), що містять елементи, які володіють більшою спорідненістю до кисню, чим залізо.
В результаті розкислювання відновлюється залізо і утворюються оксиди:, які мають меншу щільність, чим сталь, і віддаляються в шлак.
Дифузійне розкислювання здійснюється розкислюванням шлаку. Феромарганець, феросиліцій і алюміній в подрібненому вигляді завантажують на поверхню шлаку.
Залежно від ступеня розкислювання виплавляють сталі:
- спокійні
- киплячі
- напівспокійні.
Легування сталі здійснюється введенням феросплавів або чистих металів у необхідній кількості в розплав.
Чавун переробляється в сталь в різних за принципом дії металургійних агрегатах: мартенівських печах, кисневих конвертерах, електричних печах.
У основних мартенівських печах виплавляють сталі вуглецеві конструкційні, низько- і середньолеговані (марганцеві, хромисті), окрім високолегованих сталей і сплавів, які отримують в плавильних електропечах.
У кислих мартенівських печах виплавляють якісні сталі.
Киснево-конвертерний процес – виплавка сталі з рідкого чавуну в конвертері з основним футеруванням і продуванням киснем через водоохолоджувану фурму.
Кисневий конвертер – судина грушовидної форми із сталевого листа, футерована основною цеглиною.
Шихтовими матеріалами киснево-конвертерного процесу є рідкий передільний чавун, сталевий лом (не більше 30%), вапно для наведення шлаку, залізняк, а також боксит і плавиковий шпат для розрідження шлаку.
У кисневих конвертерах виплавляють сталі з різним вмістом вуглецю, киплячі і спокійні, а також низьколеговані стали. Легуючі елементи в розплавленому вигляді вводять в ківш перед випуском в нього сталі.




.jpg)
.jpg)
.png)

