Опрацювавши тему, учень:формулює визначення оксидів; знає склад оксидів; називає оксиди за сучасною номенклатурою; наводить приклади основних , кислотних та амфотерних оксидів;
розрізняє оксиди серед інших речовин; солетворні та несолетворні; класифікує оксиди за їх складом на основні, кислотні та амфотерні, солетворні та несолетворні;
висловлює судження про склад, класифікацію оксидів.
Оксидами називаються складні речовини, до яких входять два елементи, один з яких Оксиген.
Назви оксидів утворюються так: спочатку вказують назву хімічного елементу, потім, якщо елемент має змінну валентність, то її вказують римською цифрою в дужках, а потім додають слово «оксид»


Наприклад,
СО – карбон (ІІ) оксид;
СО2 – карбон (IV) оксид;
FeO – ферум (ІІ) оксид;
Al2O3 – алюміній оксид.
Деякі оксиди мають тривіальні назви, що склалися історично:
 Виконай інтерактивну вправу 1 за посиланням Номенклатура оксидів
Виконай інтерактивну вправу 1 за посиланням Номенклатура оксидів
Фізичні властивості оксидів
Оксиди є твердими, рідкими та газоподібними речовинами за звичайних умов.
Тверді речовини | Рідкі речовини | Газоподібні речовини |
SiO2 - силіцій (IV) оксид; CuO - купрум (ІІ) оксид;Р2О5 - фосфор (V) оксид
| H2O - водаСl2О7 - хлор (VII) оксид |
CO2 - карбон (IV) оксид CO - карбон (IV) оксид SO2 - сульфур (IV) оксид |
Зразки оксидів
Класифікація оксидів
Дізнаємося, чи взаємодіють оксиди з водою.
Віртуальний дослід 1. Взаємодія кальцій оксиду з водою.
Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)2. Виділення теплоти засвідчує, що відбулася реакція. Запиши рівняння цієї реакції:
СаО + Н2O = Са(ОН)2
Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів:
Na2O + Н2O = 2NaOH Натрій гідроксид
Li2O + Н2O = 2LiOH Літій гідроксид
ВаО + Н2O = Ва(ОН)2 Барій гідроксид
При цьому утворюються відповідні їм гідроксиди металів, формули яких складаються таким чином: спочатку ставиться метал, який входить до складу оксиду з тією ж валентністю, а потім додається група – ОН, яка має постійну валентність – І.
Гідроксиди металів називають основами.
Як же теоретично визначити: взаємодіє оксид з водою чи ні? Для цього потрібно перевірити чи розчинна відповідна основа чи ні. Якщо розчинна, то оксид взаємодіє з водою, якщо – ні, то не взаємодіє.
Приклади нерозчинних основ — гідроксидів металів:
Си(ОН)2 — купрум(ІІ) гідроксид
Fe(OH)3 — ферум(ІІІ) гідроксид
Аl(ОН)3 — алюміній гідроксид
Zn(OH)2 — цинк гідроксид
Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними.
Віртуальний дослід 2. Взаємодія фосфор (V) оксид з водою.
Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ортофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота:
Р2O5 + Н2O = 2НРO3 Метафосфатна кислота
Р2O5 + ЗН2O = 2Н3РO4 Ортофосфатна кислота
Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду СO2 або сульфур(VI) оксиду SO3, також утворюються кислоти.
CO2 + H2O = H2CO3 Карбонатна кислота
SO3 + Н2O = H2SO4 Сульфатна кислота
• До якого типу належать розглянуті реакції взаємодії оксидів металів і неметалів з водою? Так, до сполучень.
Щоб вивести формулу відповідної кислоти, потрібно до кислотного оксиду додати Н2О таким чином, щоб 2 атоми Гідрогену поставити перед формулою оксиду, а 1 атом Оксигену приєднати до тих, що є в оксиді. Наприклад:
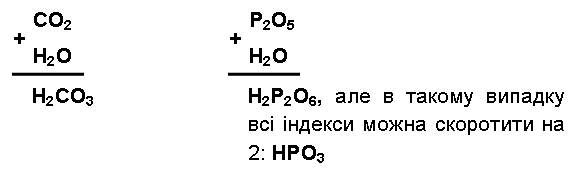
Приклади оксидів неметалів, що взаємодіють з водою:
сульфур(ІV) оксид SO2
сульфур(VІ) оксид SO3
карбон(ІV) оксид СO2
фосфор(V) оксид Р2O5
Під час взаємодії з водою багатьох оксидів неметалів утворюються кислоти.
Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними.
Виникає запитання, чи всі оксиди неметалів розчиняються у воді, утворюючи кислоти? Ні, не всі. Наприклад, силіцій(IV) оксид SiO2 (річковий пісок) у воді не розчиняється й кислоти у такий спосіб не утворює. Але це не означає, що силікатна кислота H2SiO3 не існує. Вона так само, як і інші нерозчинні кислоти, що відповідають нерозчинним оксидам неметалів, може бути добута непрямим шляхом.
Про інші хімічні властивості оксидів ти дізнаєшся пізніше.
Основнівні оксиди реагують з кислотами, утворюючи солі та воду за реакцією обміну:
Основний оксид + кислота = сіль + Н2О
Перегляньте відео за посиланням Взаємодія основного оксиду з кислотою
Під час взаємодії кислотних оксидів з водою утворюються оксигеновмісні кислоти:
Кислотний оксид + H2O = кислота HxEOy
Основні та кислотні оксиди взаємодіють між собою:
Добування оксидів
Застосування оксидів
Оксиди, що містяться у мінералах і гірських породах, широко застосовують як сировину для добування різноманітних сполук і матеріалів. Наприклад, SiO2 — сировина для виробництва скла, будівельних матеріалів, з металічних руд виплавляють метали.
Кальцій оксид використовують для добування гашеного ванна, в’яжучої основи будівельних матеріалів. Із сульфур(VІ) оксиду синтезують сульфатну кислоту, яка посідає перше місце у світі за промисловим виробництвом, як продукт і сировина для багатьох технологічних процесів.
Карбон(ІV) оксид не підтримує горіння, тому його використовують у вуглекислотних вогнегасниках (мал. 63) для гасіння горючих рідин та електроприладів, а також установок під напругою. Вуглекислий газ у твердому стані підтримує низькі температури в невеликих контейнерах і рефрижераторах. Його називають «сухий лід», він не псує продукти та не шкодить довкіллю.
Пригадайте! Чому електроприлади у разі займання потрібно гасити за допомогою вуглекислого газу?
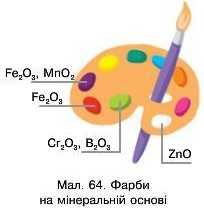
Забарвлені оксиди використовують як мінеральну основу фарб (мал. 64). Зелена фарба може містити хром(ІІІ) оксид або бор оксид; біла — цинк оксид, має назву цинкові білила; оранжева фарба (охра) містить ферум(ІІІ) оксид. Вольфрам(УІ) оксид — жовтий пігмент — використовують для зафарбовування виробів зі скла та кераміки.
Алюміній оксид використовують як вогнетривкий матеріал. Кераміка з високим вмістом алюміній оксиду дуже тверда, вогнетривка, має хороші електроізоляційні властивості. Крім того, його використовують як абразив у шліфувальних інструментах. Вольфрам(VІ) оксид, ванадій(V) оксид та багато інших використовують як каталізатори у промислових процесах.
У харчовій промисловості використовують оксиди Феруму для надання продуктам різного забарвлення. Як харчові добавки з позначенням E-172, ферум(IIІ) оксид Fe2O3 забарвлює продукти в червоний колір, а ферум(ІІ) оксид FeO — у жовтий.
Виконай інтерактивну вправу 3 за посиланням Застосування оксидів
ВИСНОВКИ
Оксиди активних металів взаємодіють з водою, утворюючи розчинні гідроксиди металів, або основи.
Оксиди металів, яким відповідають основи, називаються основними оксидами.
Оксиди неметалів взаємодіють з водою, утворюючи розчинні кислоти.
Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами.
Кислотні й основні оксиди — солетворні.








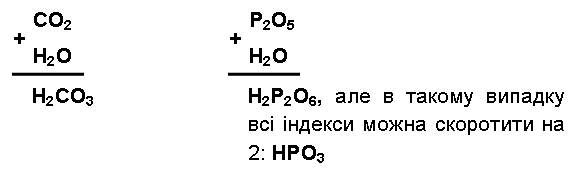













 ;
; ;
; .
.


 ;
; ;
; ;
;