Теорія:
Існують сполуки Карбону з Гідрогеном, у молекулах яких атоми Карбону сполучаються один з одним у замкнуті цикли. Це циклічні вуглеводні.
Особливу групу серед циклічних складають арени (ароматичні) сполуки. Загальна формула ароматичних вуглеводнів —
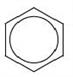
Молекулярна формула бензену — C6H6 . Структурну формулу бензену можна зобразити наступним чином:
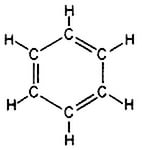
Скорочені структурні формули:
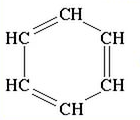
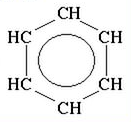
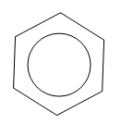
Точніше будову бензену відображає остання формула, оскільки у його молекулі відсутні подвійні зв'язки, а утворюється особливий вид ковалентного зв'язку — шестиелектронна система, зображена у вигляді кільця всередині шестикутного циклу.
Використовують також скелетні формули бензолу, в яких не вказані атоми Карбону:
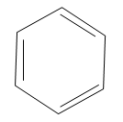
Бензен — прозора рідина з характерним запахом, легша за воду і нерозчинна у ній. Добре розчиняється в органічних розчинниках. Відноситься до отруйних сполук.
Назви аренів
Назва аренів за систематичною номенклатурою складається з назви вуглеводневого замісника і слова «бензен»:
метилбензен (толуол): C6H5−CH3 або 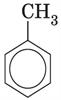 ;
;
 ;
;етилбензен: C6H5−C2H5 ;
пропілбензен: C6H5−C3H7 .
Якщо замісників декілька — положення кожного з них зазначається номером атома Карбону, з яким від зв'язан:
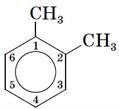 ;
;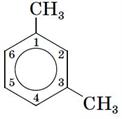 .
.Хімічні властивості бензену
Теорія:
Бензен є стійким проти дії окисників. Подібно до насичених вуглеводнів, він не змінює забарвлення розчину калій перманганату та не знебарвлює бромну воду.
Реакції заміщення
На відміну від ненасичених вуглеводнів, для бензену характерні реакції заміщення.Реакції галогенування.
Бензен вступає в реакцію з хлором (або бромом) у присутності каталізатора (хлоридів або бромідів Феруму(III ) або Алюмінію). При цьому утворюються хлоробензен і гідроген хлорид:
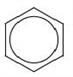
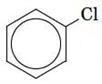
або:
У молекулі бензену усі атоми Гідрогену можна замінити на атоми Хлору:
Гексахлоробензен — безбарвна кристалічна речовина, яка використовується для протруювання насіння зернових проти шкідників.
Бензен взаємодіє з нітратною кислотою (у присутності сульфатної кислоти), утворюючи нітробензен:

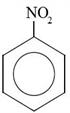
або:
Реакції приєднання
Бензен вступає у реакції приєднання, але важче ніж алкени чи алкіни.
Реакція гідрування відбувається під час нагрівання у присутності нікелевого
каталізатора. Внаслідок реакції утворюється циклогексан:

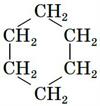 ;
;або:
При сильному освітленні бензен може приєднувати хлор — реакція приєднання галогенів. У результаті реакції утворюється 1 , 2 , 3 , 4 , 5 , 6 — гексахлороциклогексан (гексахлоран):

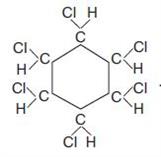 ;
;або:
Як і всі вуглеводні, бензен горить на повітрі:
3. Добування бензену
Теорія:
Бензен та його гомологи входять до складу нафти і використовуються у промисловості для синтезу барвників, вибухових речовин, полімерів.
Бензен утворюється під час пропускання етину (ацетилену) через нагріте до 600 °C активоване вугілля:
 ;
;або:
Бензен отримують дегідруванням циклогексану:
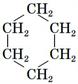

або:
Бензен можна отримати реакцією дегідрування н — гексану:

або:
Бензен та його похідні застосовується для виробництва барвників, ліків, пластмас, полімерів, вибухових речовин, отрутохімікатів, тощо.
Немає коментарів:
Дописати коментар