Ферум. Елемент Ферум розміщений у 4-му періоді в побічній підгрупі VIII групи.
Поширеність у природі. Ферум — один із найпоширеніших металічних елементів у літосфері; його атомна частка становить 1,8 %.
Відомо дуже багато природних сполук Феруму. Деякі з них слугують сировиною для виробництва заліза. Це — залізні руди: гематит (або червоний залізняк) Fe2O3, магнетит (магнітний залізняк) Fe3O4, лимоніт (бурий залізняк) Fe2O3 · nН2О (мал. 68).

Мал. 68. Природні сполуки Феруму
Україна має потужні поклади червоного залізняку в Криворізькому басейні. Пірит, або залізний колчедан, FeS2 (мал. 69) для металургії не придатний, оскільки домішка Сульфуру в залізі робить метал крихким. Цю сполуку використовують у виробництві сульфатної кислоти.

Мал. 69. Пірит
Самородне залізо у природі трапляється дуже рідко.
Невелика кількість катіонів Fe2+ міститься у природній воді. Окиснюючись розчиненим киснем, вони перетворюються на йони Fe3+, які осаджуються з води у складі бурого гідроксиду Fe(OH)3. Такий відтінок іноді має дно річки чи озера, накип у чайнику.
У живих істотах Феруму дуже мало, проте без цього елемента їх існування було б неможливим. Йони Fe2+ входять до складу гемоглобіну крові. Нестача Феруму в організмі призводить до недокрів’я.
Електронна будова атома і йонів. В атомі Феруму містяться 26 електронів (порядковий номер цього елемента — 26), які перебувають на чотирьох енергетичних рівнях (Ферум — елемент 4-го періоду). Електронна формула атома Феруму: 1s22s22p63s23p63d64s2.
• Зобразіть графічний варіант електронної формули цього атома.
Атом Феруму порівняно легко втрачає два електрони зовнішнього (четвертого) енергетичного рівня, перетворюючись на йон Fe2+. Він може позбутися ще й третього електрона — одного із d-електронів. У цьому разі утворюється йон Fe3+. У кожній його d-орбіталі перебуває по одному електрону:
![]()
Йони Fe2+ і Fe3+ містяться в сполуках Феруму(ІІ) і Феруму(ІІІ).
Проста речовина. Залізо — метал, який людина використовує вже кілька тисячоліть. Без заліза і сплавів на його основі не можна уявити розвитку нашої цивілізації.
Фізичні властивості. Залізо — сірувато-сріблястий пластичний метал. Він має густину 7,87 г/см3, плавиться за температури 1539 °С, є феромагнетиком. Цей метал утворює сплави з багатьма металами.
Хімічні властивості. Залізо виявляє в хімічних реакціях достатню активність. Якщо його добути у вигляді дуже дрібного порошку (наприклад, розкладаючи органічні сполуки Феруму), то метал набуває здатності самозайматися на повітрі. Таку властивість речовини називають пірофoрністю1.
1 Термін походить від грецьких слів pyr — вогонь і phoros — той, що несе.
Реакції з неметалами. При нагріванні залізо реагує з багатьма неметалами. Сталеве лезо або пружинка із закріпленим палаючим сірником згоряє в кисні (мал. 70):
![]()

Мал. 70. Реакція заліза з киснем
Залізо горить і в атмосфері хлору (мал. 71), при нагріванні активно взаємодіє із сіркою:
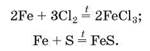

Мал. 71. Реакція заліза із хлором
Реакції з водою. Якщо залізні ошурки або цвях помістити у воду, то з часом на поверхні металу з’явиться іржа. Це — продукт взаємодії заліза з водою і розчиненим у ній киснем. Іржа має змінний склад — Fe2O3 · nН2О. У хімічному рівнянні її формулу для спрощення запишемо як Fe(OH)3 (цю формулу можна подати і так: Fe2O3 · 3Н2О):
4Fe + 6Н2О + 3О2 = 4Fe(OH)3.
Розжарене залізо взаємодіє з водяною парою:
![]()
Раніше на цій реакції ґрунтувався промисловий метод добування водню.
Реакції з кислотами. Залізо взаємодіє із хлоридною, розбавленою сульфатною та деякими іншими кислотами з виділенням водню й утворенням солей Феруму(ІІ):
Fe + H2SO4 (розб.) = FeSO4 + Н2↑.
Із концентрованими нітратною та сульфатною кислотами залізо, як і алюміній, за звичайних умов майже не реагує через утворення на поверхні металу хімічно пасивної оксидної плівки. Тому ці кислоти транспортують у залізних цистернах. При нагріванні оксидна плівка взаємодіє з кислотою й відразу в реакцію вступає метал (мал. 72):
![]()
• Доберіть коефіцієнти методом електронного балансу.

Мал. 72. Реакція заліза з концентрованою нітратною кислотою
Ферум. Елемент Ферум розміщений у 4-му періоді в побічній підгрупі VIII групи.
Поширеність у природі. Ферум — один із найпоширеніших металічних елементів у літосфері; його атомна частка становить 1,8 %.
Відомо дуже багато природних сполук Феруму. Деякі з них слугують сировиною для виробництва заліза. Це — залізні руди: гематит (або червоний залізняк) Fe2O3, магнетит (магнітний залізняк) Fe3O4, лимоніт (бурий залізняк) Fe2O3 · nН2О (мал. 68).

Мал. 68. Природні сполуки Феруму
Україна має потужні поклади червоного залізняку в Криворізькому басейні. Пірит, або залізний колчедан, FeS2 (мал. 69) для металургії не придатний, оскільки домішка Сульфуру в залізі робить метал крихким. Цю сполуку використовують у виробництві сульфатної кислоти.

Мал. 69. Пірит
Самородне залізо у природі трапляється дуже рідко.
Невелика кількість катіонів Fe2+ міститься у природній воді. Окиснюючись розчиненим киснем, вони перетворюються на йони Fe3+, які осаджуються з води у складі бурого гідроксиду Fe(OH)3. Такий відтінок іноді має дно річки чи озера, накип у чайнику.
У живих істотах Феруму дуже мало, проте без цього елемента їх існування було б неможливим. Йони Fe2+ входять до складу гемоглобіну крові. Нестача Феруму в організмі призводить до недокрів’я.
Електронна будова атома і йонів. В атомі Феруму містяться 26 електронів (порядковий номер цього елемента — 26), які перебувають на чотирьох енергетичних рівнях (Ферум — елемент 4-го періоду). Електронна формула атома Феруму: 1s22s22p63s23p63d64s2.
• Зобразіть графічний варіант електронної формули цього атома.
Атом Феруму порівняно легко втрачає два електрони зовнішнього (четвертого) енергетичного рівня, перетворюючись на йон Fe2+. Він може позбутися ще й третього електрона — одного із d-електронів. У цьому разі утворюється йон Fe3+. У кожній його d-орбіталі перебуває по одному електрону:
![]()
Йони Fe2+ і Fe3+ містяться в сполуках Феруму(ІІ) і Феруму(ІІІ).
Проста речовина. Залізо — метал, який людина використовує вже кілька тисячоліть. Без заліза і сплавів на його основі не можна уявити розвитку нашої цивілізації.
Фізичні властивості. Залізо — сірувато-сріблястий пластичний метал. Він має густину 7,87 г/см3, плавиться за температури 1539 °С, є феромагнетиком. Цей метал утворює сплави з багатьма металами.
Хімічні властивості. Залізо виявляє в хімічних реакціях достатню активність. Якщо його добути у вигляді дуже дрібного порошку (наприклад, розкладаючи органічні сполуки Феруму), то метал набуває здатності самозайматися на повітрі. Таку властивість речовини називають пірофoрністю1.
1 Термін походить від грецьких слів pyr — вогонь і phoros — той, що несе.
Реакції з неметалами. При нагріванні залізо реагує з багатьма неметалами. Сталеве лезо або пружинка із закріпленим палаючим сірником згоряє в кисні (мал. 70):
![]()

Мал. 70. Реакція заліза з киснем
Залізо горить і в атмосфері хлору (мал. 71), при нагріванні активно взаємодіє із сіркою:
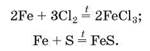

Мал. 71. Реакція заліза із хлором
Реакції з водою. Якщо залізні ошурки або цвях помістити у воду, то з часом на поверхні металу з’явиться іржа. Це — продукт взаємодії заліза з водою і розчиненим у ній киснем. Іржа має змінний склад — Fe2O3 · nН2О. У хімічному рівнянні її формулу для спрощення запишемо як Fe(OH)3 (цю формулу можна подати і так: Fe2O3 · 3Н2О):
4Fe + 6Н2О + 3О2 = 4Fe(OH)3.
Розжарене залізо взаємодіє з водяною парою:
![]()
Раніше на цій реакції ґрунтувався промисловий метод добування водню.
Реакції з кислотами. Залізо взаємодіє із хлоридною, розбавленою сульфатною та деякими іншими кислотами з виділенням водню й утворенням солей Феруму(ІІ):
Fe + H2SO4 (розб.) = FeSO4 + Н2↑.
Із концентрованими нітратною та сульфатною кислотами залізо, як і алюміній, за звичайних умов майже не реагує через утворення на поверхні металу хімічно пасивної оксидної плівки. Тому ці кислоти транспортують у залізних цистернах. При нагріванні оксидна плівка взаємодіє з кислотою й відразу в реакцію вступає метал (мал. 72):
![]()
• Доберіть коефіцієнти методом електронного балансу.

Мал. 72. Реакція заліза з концентрованою нітратною кислотою
Реакції із солями. Залізо «витісняє» із солей у розчинах менш активні метали — мідь, срібло, бісмут та ін. При цьому, крім них, утворюються солі Феруму(ІІ), але не Феруму(ІІІ):
3Fe + 2ВiСl3 = 3FeCl2 + 2Вi.
Оксиди Феруму. Ферум утворює три сполуки з Оксигеном: прості оксиди FeO, Fe2O3 і подвійний оксид Fe3O4 (або FeO · Fe2O3). Це — тверді речовини чорного (FeO і Fe3O4) або коричневого (Fe2O3) кольору. Докладно розглядатимемо лише прості оксиди (мал. 73).

Мал. 73. Оксиди Феруму
Ферум(ІІ) оксид і ферум(ІІІ) оксид можна добути термічним розкладом відповідних гідроксидів, деяких оксигеновмісних солей:

Необхідною умовою для добування чистого ферум(ІІ) оксиду є відсутність кисню, інакше сполука реагує з ним, перетворюючись на оксид Fe3O4 або Fe2O3.
Прості оксиди Феруму різняться за хімічним характером: FeO — основний оксид, Fe2O3 — амфотерний. Вони реагують з кислотними оксидами та кислотами.
• Напишіть рівняння реакцій: а) між оксидами FeO і Р2О5; б) оксиду Fe2O3 із сульфатною кислотою.
Ферум(ІІІ) оксид не реагує з розчином лугу. Взаємодія цього оксиду з лугами відбувається лише при сплавлянні чи спіканні сполук. Продуктами реакцій є солі — ферити:
![]()
Цікаво знати
Деякі ферити використовують у техніці як магнітні матеріали.
Гідроксиди Феруму нерозчинні у воді; сполука Fe(OH)2 має білий колір, іноді із зеленкуватим відтінком, a Fe(OH)3 — бурий (мал. 74).

Мал. 74. Гідроксиди Феруму
Добути чистий ферум(ІІ) гідроксид за реакцією обміну у водному розчині дуже важко; він досить швидко окиснюється розчиненим у воді киснем повітря й перетворюється на ферум(ІІІ) гідроксид:
Fe(OH)2 + О2 + Н2О → Fe(OH)3.
• Перетворіть схему реакції на хімічне рівняння.
За хімічним характером гідроксиди Феруму подібні до відповідних оксидів: сполука Fe(OH)2 є основою, a Fe(OH)3 — амфотерним гідроксидом, який, однак, майже не реагує з розчином лугу за звичайних умов.
Солі Феруму. Елемент Ферум утворює багато солей. Солі Феруму(ІІ) містять катіони Fe2+, а в солях Феруму(ІІІ) цей металічний елемент може перебувати у формі катіонів Fe3+ (FeF3, Fe2(SO4)3) або бути складником аніонів кислотних залишків (NaFeO2, K3FeO3).
• Чим зумовлене існування двох типів солей Феруму(ІІІ)?
Розчинні солі Феруму при випарюванні води з їх розчинів виділяються у вигляді кристалогідратів — FeSO4 · 7Н2О, FeCl3 · 6Н2О тощо (мал. 75). Більшість солей Феруму(ІІ) зеленкувато-блакитні, а солі Феруму(ІІІ) мають різне забарвлення; зокрема, сполука FeCl3 · 6Н2О — коричневий, Fe2(SO4)3 · 9Н2О — білий, Fe(NO3)3· 9Н2О — блідо-бузковий.

Мал. 75. Солі Феруму
Солі Феруму зазнають гідролізу; їх розчини мають кисле середовище:
![]()
Добути деякі солі Феруму(ІІІ) через одночасний гідроліз катіонів і аніонів не вдається:
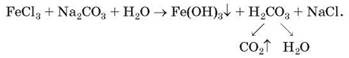
Цікаво знати
Існує кілька сполук Феруму(VІ) — фератів: K2FeO4, BaFeO4 та ін.
Застосування сполук Феруму. Сполуки Феруму широко використовують на практиці. Оксиди Fe2O3 і Fe3O4 є сировиною для чорної металургії. Природні гідрати ферум(ІІІ) оксиду Fe2O3 · nН2О забарвлені в різні кольори — від жовто-коричневого до бурого; вони слугують пігментами у фарбах — охрі (жовта), залізному сурику та мумії (червоно-коричневі). Подвійний оксид Fe3O4 використовують як матеріал електродів для електролізу, а також у лужних акумуляторах. Найважливішою сіллю Феруму є залізний купорос (ферум(ІІ) сульфат, гептагідрат) FeSO4 · 7Н2О. Сполуку застосовують для консервування деревини, боротьби із хворобами рослин, як відновник і вихідну речовину для добування різних сполук Феруму.
ВИСНОВКИ
Ферум — один із найважливіших металічних елементів. Він належить до d-елементів, утворює просту речовину — залізо.
Залізо реагує з більшістю неметалів, кислотами, розчинами багатьох солей, а за наявності води і кисню ржавіє.
Для Феруму відомі оксиди FeO, Fe2O3 і Fe3O4. Оксид FeO є основним, a Fe2O3 — амфотерним. Гідроксиди Fe(OH)2 і Fe(OH)3 за хімічним характером подібні до відповідних оксидів. Оксиди і гідроксиди Феруму реагують із кислотами, а ферум(ІІІ) оксид при нагріванні — ще й із лугами.
Солі Феруму мають різне забарвлення, а розчинні у воді утворюють кристалогідрати.
Оксиди та солі Феруму використовують у багатьох сферах.
Тренувальні вправи:::
- 193. Запишіть формули мінералів Fe3Al2(SiO4)3 і Ca3Fe2(SiO4)3 (їх загальна назва — гранати) за допомогою формул відповідних оксидів.
- 194. Складіть електронні формули катіонів Феруму та зобразіть їх графічні варіанти.
- 195. Допишіть схеми реакцій і складіть хімічні рівняння:

- 196. Вставте замість крапок формули речовин і перетворіть схеми реакцій на хімічні рівняння:

- 197. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) Fe → FeCl2 → FeCl3 → Fe(OH)3 → Fe2(SO4)3 → FePO4;
б) Fe2O3 → Ba(FeO2)2 → Fe2(SO4)3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3.
- 198. Ферум(ІІ, III) оксид реагує з кислотами подібно до суміші простих оксидів Феруму. Складіть рівняння реакцій сполуки Fe3O4 з хлоридною і розбавленою сульфатною кислотами.
- 199. Напишіть рівняння гідролізу нітратів Феруму в молекулярній та йонно-молекулярній формах. Зважте на те, що осади не утворюються.
- 200. Під час пропускання сірководню у водний розчин ферум(ІІІ) хлориду утворюється світло-жовтий осад простої речовини. Складіть рівняння реакції.
- 201. Виведіть формулу оксиду Феруму, в якому масова частка металічного елемента становить 70 %.
- 202. Яку масу ферум(ІІІ) нітрату потрібно взяти для добування 8 г ферум(ІІІ) оксиду?
- 203. Визначте кількість молекул води у формулі солі FeCl2 · nH2O, якщо масова частка води у сполуці становить 36,2 %.
- 204. Який об’єм водню виділиться за нормальних умов, якщо до 1,12 г заліза додати 18 г хлоридної кислоти з масовою часткою НСl 10 %?
- 205. У розчин купрум(ІІ) сульфату занурили залізну пластинку масою 28 г. Через деякий час маса пластинки збільшилась до 30 г. Обчисліть масу міді, яка виділилась на пластинці. Зважте на те, що утворюваний метал із пластинки не осипається.
Немає коментарів:
Дописати коментар