Характеристика окисно-відновних реакцій
Окисно-відновні реакції (ОВР) — це реакції, в яких відбувається зміна ступенів окиснення атомів елементів.
В ОВР відбувається перехід електронів від одних атомів до інших, одночасно протікають два протилежні процеси: окиснення і відновлення.
Окиснення — процес віддачі електронів.
Елемент, який віддає електрони — відновник.
Окиснення:
Відновлення — процес прийняття електронів.
Елемент, що приймає електрони — окисник.
Відновлення:
Зверни увагу!
В ОВР відновник окиснюється, а окисник відновлюється.
Сумарний заряд усіх частинок, що беруть участь в окисно-відновній реакції, не змінюється. У схемах процесів окиснення і відновлення суми зарядів зліва і справа рівні. Наприклад:
Зверни увагу!
Під час протіканні ОВР ступінь окиснення відновника підвищується, а ступінь окиснення окисника понижується.
Окисно-відновні реакції є найпоширенішими у природі і на виробництві. У природі — це фотосинтез, дихання, бродіння, гниття. У промисловості їх використовують для отримання металів, добрив. У повсякденному житті ми спостерігаємо горіння палива, іржавіння заліза та інші реакції.
Для того щоб визначити, чи є реакція окисно-відновною, потрібно:
- вказати ступінь окиснення усіх елементів у вихідних речовинах і продуктах реакції;
- порівняти ступені окиснення кожного елемента у вихідних речовинах і у продуктах.
Приклад:
визначимо, чи є реакція окисно-відновною:
Розставимо ступені окиснення:
Жоден з елементів не змінив ступінь окиснення. Отже, реакція не відноситься до окисно-відновних.
Розглянемо реакцію цинку з соляною кислотою:
Вкажемо ступені окиснення:
Змінилися ступені окиснення Цинку і Гідрогену, отже, реакція є окисно-відновною.
Знайдемо у реакції взаємодії цинку з хлоридною кислотою окисник і відновник, визначимо процеси відновлення і окиснення і число електронів, яке переміщається від відновника до окисника.
Приклад:
Складемо схеми окиснення і відновлення:
відновник
окисник
Електрони в реакціях не зникають і не з'являються. Тому число електронів, які віддає відновник, завжди дорівнює числу електронів, які приймає окисник. У реакції атом Цинку віддає 2 електрони двом атомам Гідрогену:
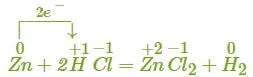
Атоми з мінімальними значеннями ступенів окиснення можуть бути тільки відновниками.
Атоми з максимальними значеннями ступенів окиснення можуть бути тільки окисниками.
Атоми з проміжними значеннями ступенів окиснення можуть бути і окисниками, і відновниками.
Приклад:
атоми Сульфуру зі ступенем окиснення –2 в окисно-відновних реакціях завжди є відновниками (H2S ).
Атоми Сульфуру зі ступенем окиснення +6 можуть бути лише окисниками (H2SO4 ).
Якщо ступінь окиснення Сульфуру +4 , то його атоми можуть проявляти як окисні, так і відновні властивості (SO2 ).
Найважливіші відновники:
- метали;
- водень
H2 ; - вугілля
C ; - Карбон(
II ) оксидCO ; - гідроген сульфід (сірководень)
H2S , сульфідиK2S ; - сполуки Гідрогену з галогенами
HI ,HBr ; - амоніак
NH3 .
Найважливіші окисники:
- галогени
F2 ,Cl2 ; - кисень
O2 , озонO3 ; - сполуки Мангану
KMnO4 ; - нітратна кислота
HNO3 , та її соліKNO3 ; - концентрована сульфатна кислота
H2SO4 ; - йони металів.Значення окисно - відновних реакцій:
Немає коментарів:
Дописати коментар